chemisches Gleichgewicht: das Prinzip von Le Chatelier
26/01/16 16:12
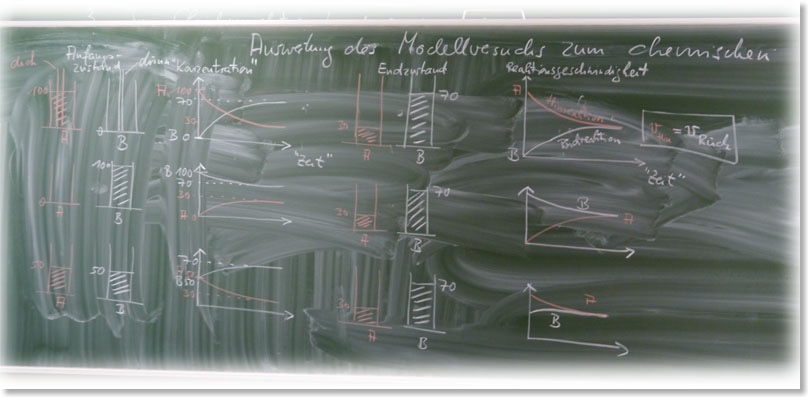
1. Kennzeichen des dynamischen chemischen Gleichgewichts: Auswertung des Modellversuchs vom 20.01.

Arbeitsblatt "Apfelkrieg": Apfelkrieg

Protokoll (Gemma): Chemieprotokoll26-01-16A
2. Das Prinzip von Le Chatelier: chemische Gleichgewichte qualitativ betrachtet
a) Einfluss der Temperatur auf die Lage des Gleichgewichts
– NO2-N2O4-Gleichgewicht (exotherme Reaktion)
links aufgeheizt; rechts Raumtemperatur

Abkühlen

– Iod-Stärke-Gleichgewicht (exotherme Reaktion)

Aufheizen:

Abkühlen

b) Einfluss der Konzentration auf die Lage des Gleichgewichts
– Fe(III)-SCN-Gleichgewicht


von links nach rechts: 1. Vergleichslösung (rote Farbe von Fe(SCN)3; 2. Zugabe von Fe(III); 3. Zugabe von (SCN-); 4. Zugabe von OH- (-> Ausfallen von Fe(OH)3)
Zusammenfassung der Experimente:

c) Einfluss des Katalysators auf die Lage des Gleichgewichts: nur auf die Schnelligkeit, mit der sich das Gleichgewicht einstellt!
Protokoll (Tekla): Chemieprotokoll26-01-16B


Arbeitsblatt "Apfelkrieg": Apfelkrieg

Protokoll (Gemma): Chemieprotokoll26-01-16A
2. Das Prinzip von Le Chatelier: chemische Gleichgewichte qualitativ betrachtet
a) Einfluss der Temperatur auf die Lage des Gleichgewichts
– NO2-N2O4-Gleichgewicht (exotherme Reaktion)
links aufgeheizt; rechts Raumtemperatur

Abkühlen

– Iod-Stärke-Gleichgewicht (exotherme Reaktion)

Aufheizen:

Abkühlen

b) Einfluss der Konzentration auf die Lage des Gleichgewichts
– Fe(III)-SCN-Gleichgewicht


von links nach rechts: 1. Vergleichslösung (rote Farbe von Fe(SCN)3; 2. Zugabe von Fe(III); 3. Zugabe von (SCN-); 4. Zugabe von OH- (-> Ausfallen von Fe(OH)3)
Zusammenfassung der Experimente:

c) Einfluss des Katalysators auf die Lage des Gleichgewichts: nur auf die Schnelligkeit, mit der sich das Gleichgewicht einstellt!
Protokoll (Tekla): Chemieprotokoll26-01-16B