chemisches Gleichgewicht: das Prinzip von Le Chatelier
26/01/16 16:12
1. Kennzeichen des dynamischen chemischen Gleichgewichts: Auswertung des Modellversuchs vom 20.01.

Arbeitsblatt "Apfelkrieg": Apfelkrieg

Protokoll (Gemma): Chemieprotokoll26-01-16A
2. Das Prinzip von Le Chatelier: chemische Gleichgewichte qualitativ betrachtet
a) Einfluss der Temperatur auf die Lage des Gleichgewichts
– NO2-N2O4-Gleichgewicht (exotherme Reaktion)
links aufgeheizt; rechts Raumtemperatur

Abkühlen

– Iod-Stärke-Gleichgewicht (exotherme Reaktion)

Aufheizen:

Abkühlen

b) Einfluss der Konzentration auf die Lage des Gleichgewichts
– Fe(III)-SCN-Gleichgewicht


von links nach rechts: 1. Vergleichslösung (rote Farbe von Fe(SCN)3; 2. Zugabe von Fe(III); 3. Zugabe von (SCN-); 4. Zugabe von OH- (-> Ausfallen von Fe(OH)3)
Zusammenfassung der Experimente:

c) Einfluss des Katalysators auf die Lage des Gleichgewichts: nur auf die Schnelligkeit, mit der sich das Gleichgewicht einstellt!
Protokoll (Tekla): Chemieprotokoll26-01-16B


Arbeitsblatt "Apfelkrieg": Apfelkrieg

Protokoll (Gemma): Chemieprotokoll26-01-16A
2. Das Prinzip von Le Chatelier: chemische Gleichgewichte qualitativ betrachtet
a) Einfluss der Temperatur auf die Lage des Gleichgewichts
– NO2-N2O4-Gleichgewicht (exotherme Reaktion)
links aufgeheizt; rechts Raumtemperatur

Abkühlen

– Iod-Stärke-Gleichgewicht (exotherme Reaktion)

Aufheizen:

Abkühlen

b) Einfluss der Konzentration auf die Lage des Gleichgewichts
– Fe(III)-SCN-Gleichgewicht


von links nach rechts: 1. Vergleichslösung (rote Farbe von Fe(SCN)3; 2. Zugabe von Fe(III); 3. Zugabe von (SCN-); 4. Zugabe von OH- (-> Ausfallen von Fe(OH)3)
Zusammenfassung der Experimente:

c) Einfluss des Katalysators auf die Lage des Gleichgewichts: nur auf die Schnelligkeit, mit der sich das Gleichgewicht einstellt!
Protokoll (Tekla): Chemieprotokoll26-01-16B
chemisches Gleichgewicht: Modellversuch
20/01/16 16:11
1. Auswertung der Katalyse-Versuche vom 19.01.: Wie wirkt ein Katalysator?
a) Betrachtung auf Teilchenebene (Mikrokosmos)
Simulation zur Temperaturabhängigkeit der (Maxwellschen) Geschwindigkeitsverteilung der kinetischen Energie der Teilchen: gas-properties_de
https://phet.colorado.edu

b) Betrachtung auf Stoffebene (Makrokosmos)
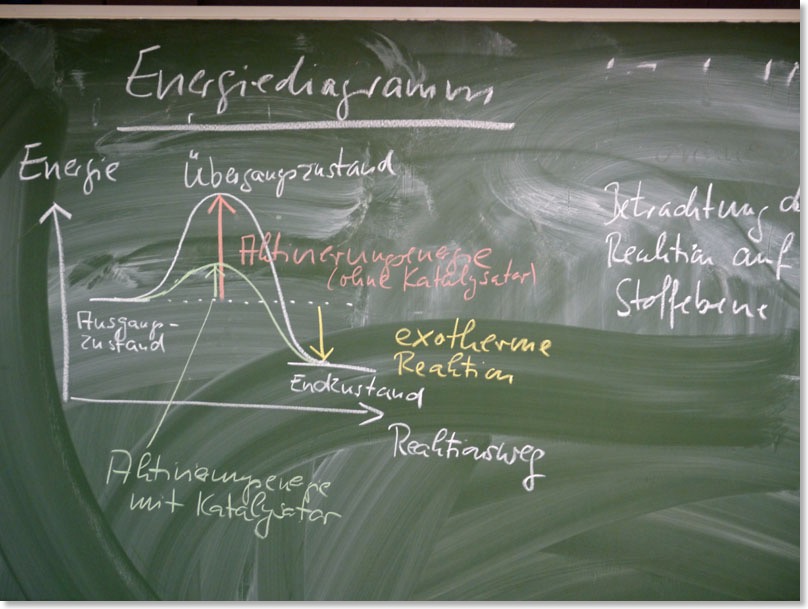
c) Kennzeichen des Katalysators
d) Film "Katalysatoren – Multitalent Katalysator" (Max Planck Gesellschaft): https://www.youtube.com/watch?v=1LFXYQej8_c
e) Homogene und heterogene Katalyse
f) Technisch bedeutsame Katalyse-Reaktionen:
– Ammoniaksynthese (Haber-Bosch-Verfahren)
– Salpetersäuresynthese (Ostwald-Verfahren)
– Schwefelsäuresynthese (Kontakt-Verfahren)
– Benzin- bzw. Diesel-Abgaskatalysator (siehe 13.01.)
– Methanolsynthese
– Fischer-Tropsch-Verfahren
– PE-Synthese
– Enzymkatalyse (z. B. Katalase)
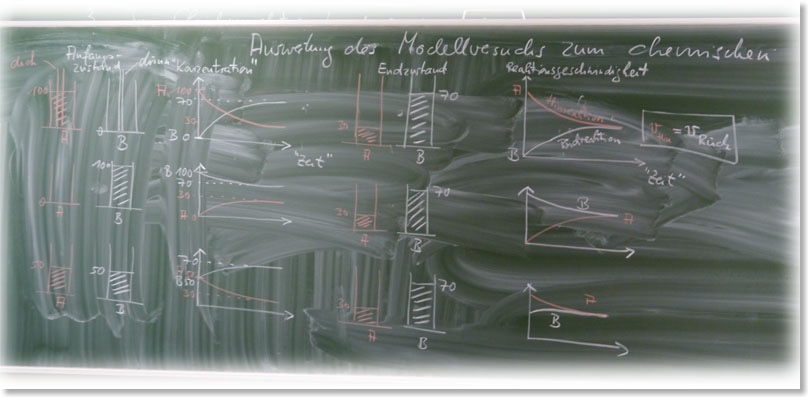
2. Modellversuch zu Reaktionsgeschwindigkeit und chemischen Gleichgewicht
Aufbau und Durchführung:

Anfangszustand I: links: Stoff A (100 mL), dickes Röhrchen; rechts: Stoff B (0 mL), dünnes Röhrchen

Anfangszustand II: links: Stoff A (0 mL), dickes Röhrchen; rechts: Stoff B (100 mL), dünnes Röhrchen

Anfangszustand III: links: Stoff A (50 mL), dickes Röhrchen; rechts: Stoff B (50 mL), dünnes Röhrchen

Endzustand – unabhängig vom Anfangszustand -> Gleichgewicht: links: Stoff A (30 mL), dickes Röhrchen; rechts: Stoff B (70 mL), dünnes Röhrchen

Protokoll (Lisbeth): Chemieprotokoll20-01-16
a) Betrachtung auf Teilchenebene (Mikrokosmos)
Simulation zur Temperaturabhängigkeit der (Maxwellschen) Geschwindigkeitsverteilung der kinetischen Energie der Teilchen: gas-properties_de
https://phet.colorado.edu

b) Betrachtung auf Stoffebene (Makrokosmos)

c) Kennzeichen des Katalysators
d) Film "Katalysatoren – Multitalent Katalysator" (Max Planck Gesellschaft): https://www.youtube.com/watch?v=1LFXYQej8_c
e) Homogene und heterogene Katalyse
f) Technisch bedeutsame Katalyse-Reaktionen:
– Ammoniaksynthese (Haber-Bosch-Verfahren)
– Salpetersäuresynthese (Ostwald-Verfahren)
– Schwefelsäuresynthese (Kontakt-Verfahren)
– Benzin- bzw. Diesel-Abgaskatalysator (siehe 13.01.)
– Methanolsynthese
– Fischer-Tropsch-Verfahren
– PE-Synthese
– Enzymkatalyse (z. B. Katalase)
2. Modellversuch zu Reaktionsgeschwindigkeit und chemischen Gleichgewicht
Aufbau und Durchführung:

Anfangszustand I: links: Stoff A (100 mL), dickes Röhrchen; rechts: Stoff B (0 mL), dünnes Röhrchen

Anfangszustand II: links: Stoff A (0 mL), dickes Röhrchen; rechts: Stoff B (100 mL), dünnes Röhrchen

Anfangszustand III: links: Stoff A (50 mL), dickes Röhrchen; rechts: Stoff B (50 mL), dünnes Röhrchen

Endzustand – unabhängig vom Anfangszustand -> Gleichgewicht: links: Stoff A (30 mL), dickes Röhrchen; rechts: Stoff B (70 mL), dünnes Röhrchen

Protokoll (Lisbeth): Chemieprotokoll20-01-16
Reaktionsbedingungen II: Katalyse
19/01/16 16:09
1. Auswertung der Versuche vom 12.01.
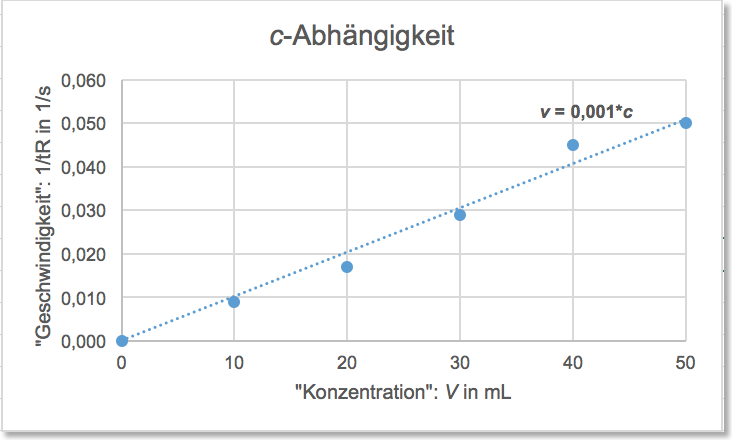
a) c-Abhängigkeit
b) T-Abhängigkeit

Zusammenfassung in der Geschwindigkeitsgleichung
2. Knallgasreaktion
a) Aktivierungsenergie

b) Pt-Pd-Katalysator

3. Zersetzung von Wasserstoffperoxid
a) Pt-Pd-Katalysator

b) Braunstein (MnO2) + Glimmspanprobe

c) Katalase + Glimmspanprobe

Protokoll (Jan): Chemieprotokoll19-01-16
a) c-Abhängigkeit

b) T-Abhängigkeit

Zusammenfassung in der Geschwindigkeitsgleichung
2. Knallgasreaktion
a) Aktivierungsenergie

b) Pt-Pd-Katalysator

3. Zersetzung von Wasserstoffperoxid
a) Pt-Pd-Katalysator

b) Braunstein (MnO2) + Glimmspanprobe

c) Katalase + Glimmspanprobe

Protokoll (Jan): Chemieprotokoll19-01-16
Präsentationen: Technische Katalysen
13/01/16 17:00
Gruppe Benzinabgase (Chiara, Gemma, Mareike, Max): Benzin Handout: BenzinHandout
Gruppe Dieselabgase (Fred, Merle M., Nila, Tekla): Diesel
Gruppe Bier brauen (Angelo, Maddy): BiER
Gruppe HDPE (Christof, Felix, Jan, Merle S.): ausgefallen
Gruppe Dieselabgase (Fred, Merle M., Nila, Tekla): Diesel
Gruppe Bier brauen (Angelo, Maddy): BiER
Gruppe HDPE (Christof, Felix, Jan, Merle S.): ausgefallen
Reaktionsbedingungen I: Konzentration und Temperatur
12/01/16 17:00
1. Wiederholung Grundbegriffe:
– Unterschied zwischen Reaktionszeit und Reaktionsgeschwindigkeit
– Unterschied zwischen Durchschnittsgeschwindigkeit und Momentangeschwindigkeit
2. Faktoren, die die Geschwindigkeit einer chemischen Reaktion beeinflussen.
3. Versuch 1: Konzentrationsabhängigkeit
4. Versuch 2: Temperaturabhängigkeit
am Beispiel: Natriumthiosulfat/Salzsäure



Protokoll (Max): Chemieprotokoll16-01-12
– Unterschied zwischen Reaktionszeit und Reaktionsgeschwindigkeit
– Unterschied zwischen Durchschnittsgeschwindigkeit und Momentangeschwindigkeit
2. Faktoren, die die Geschwindigkeit einer chemischen Reaktion beeinflussen.
3. Versuch 1: Konzentrationsabhängigkeit
4. Versuch 2: Temperaturabhängigkeit
am Beispiel: Natriumthiosulfat/Salzsäure



Protokoll (Max): Chemieprotokoll16-01-12