Chemie-Projekttag
08/06/16 16:00
1. Projekt 1:
Redoxtitration -> Iodometrie -> Bestimmung von schwefliger Säure in Weißwein
– Vorversuch: Titration von Iod-Lösung mit Thiosulfat-Lösung



50 mL Iod-Lösung (c = 0,025 mol/L) wird mit Thiosulfat-Lösung titriert bis die Iod-Farbe fast verschwindet, dann Zugabe von 1 mL Stärke-Lösung (2 %) und weitertitriert bis zur Entfärbung.
– Hauptversuch: Bestimmung der schwefligen Säure in Weißwein nach dem Rücktitrationsverfahren


50 mL Weißwein + 50 mL Schwefelsäure (c = 0,5 mol/L) + Überschuss an Iod-Lösung: V(I2) = 10 mL, c(I2)= 0,025 mol/L + 1 mL Stärkelösung (2 %); Titration mit Thiosulfat-Lösung bis zur Entfärbung
– Lewis-Formeln des Sulfat-Ions, des Thiosulfat-Ions, des Sulfid-Ions + Bestimmung der Oxidationszahlen der Schwefelatome
Protokoll (Chiara): Chemieprotokoll08-06-16A
2. Projekt 2:
Von der Silberkonzentrationszelle zur pH-Einstab-Messkette
– Messungen an der Silberkonzentrationszelle: c (Ag+) = 0,01; 0,001; 0,0001 mol/L gegen c(Ag+) = 0,1 mol/L
– Deutung: Elektrochemische Gleichgewichte an den Ag/Ag+-Elektroden -> Konzentrationsabhängigkeit des Elektrodenpotenzials
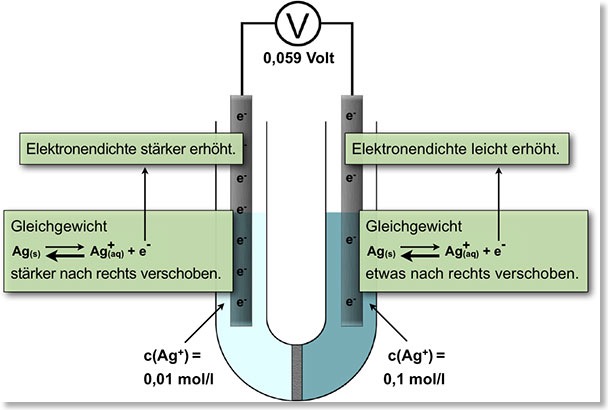
– Nernst-Gleichung: Berechnung des Elektrodenpotenzials in Abhängigkeit von der Konzentration des Metall-Ions
– Übertragung auf alle Redoxsysteme -> wichtiges Beispiel: pH-Abhängigkeit des Elektrodenpotenzials -> Änderung des Elektrodenpotenzials des Redoxpaares (H2/H+) in Abhängigkeit vom pH-Wert (pH = 0, 7, 14, Elektrodenpotenziale: siehe Tafelwerk)
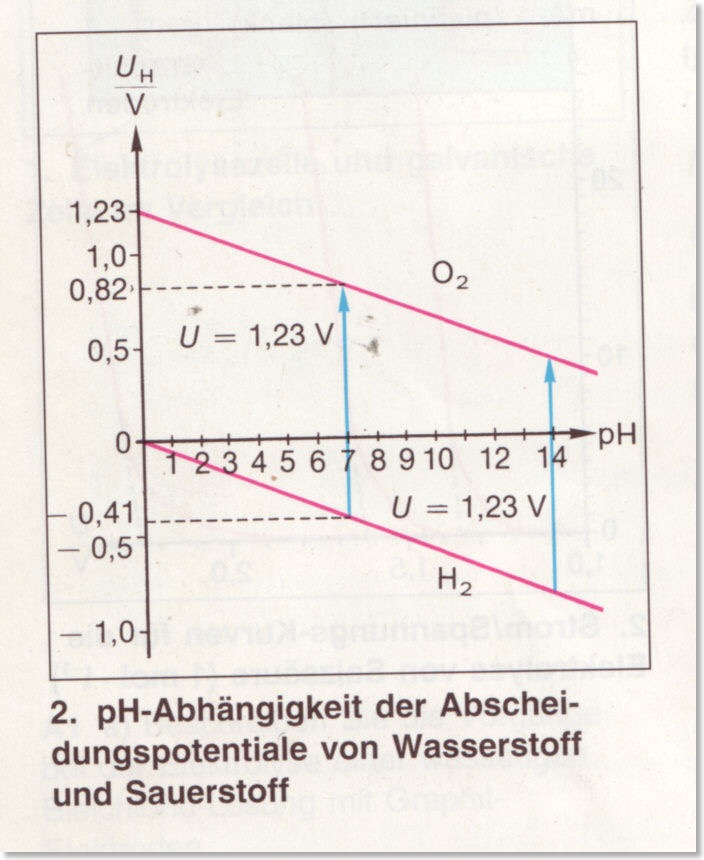
– Wichtige Anwendung: pH-Einstab-Messkette

Protokoll (Fred): Chemieprotokoll08-06-16B
Redoxtitration -> Iodometrie -> Bestimmung von schwefliger Säure in Weißwein
– Vorversuch: Titration von Iod-Lösung mit Thiosulfat-Lösung



50 mL Iod-Lösung (c = 0,025 mol/L) wird mit Thiosulfat-Lösung titriert bis die Iod-Farbe fast verschwindet, dann Zugabe von 1 mL Stärke-Lösung (2 %) und weitertitriert bis zur Entfärbung.
– Hauptversuch: Bestimmung der schwefligen Säure in Weißwein nach dem Rücktitrationsverfahren


50 mL Weißwein + 50 mL Schwefelsäure (c = 0,5 mol/L) + Überschuss an Iod-Lösung: V(I2) = 10 mL, c(I2)= 0,025 mol/L + 1 mL Stärkelösung (2 %); Titration mit Thiosulfat-Lösung bis zur Entfärbung
– Lewis-Formeln des Sulfat-Ions, des Thiosulfat-Ions, des Sulfid-Ions + Bestimmung der Oxidationszahlen der Schwefelatome
Protokoll (Chiara): Chemieprotokoll08-06-16A
2. Projekt 2:
Von der Silberkonzentrationszelle zur pH-Einstab-Messkette
– Messungen an der Silberkonzentrationszelle: c (Ag+) = 0,01; 0,001; 0,0001 mol/L gegen c(Ag+) = 0,1 mol/L
– Deutung: Elektrochemische Gleichgewichte an den Ag/Ag+-Elektroden -> Konzentrationsabhängigkeit des Elektrodenpotenzials

– Nernst-Gleichung: Berechnung des Elektrodenpotenzials in Abhängigkeit von der Konzentration des Metall-Ions
– Übertragung auf alle Redoxsysteme -> wichtiges Beispiel: pH-Abhängigkeit des Elektrodenpotenzials -> Änderung des Elektrodenpotenzials des Redoxpaares (H2/H+) in Abhängigkeit vom pH-Wert (pH = 0, 7, 14, Elektrodenpotenziale: siehe Tafelwerk)

– Wichtige Anwendung: pH-Einstab-Messkette

Protokoll (Fred): Chemieprotokoll08-06-16B