June 2016
Abituraufgabe Kohlensäure
21/06/16 15:22
Saure und alkalische Salze?!
14/06/16 14:03
1. Die Lösungen von Salzen in Wasser können neutral, alkalisch und sauer reagieren.

von links nach rechts: Natriumchlorid, Natriumacetat, Ammoniumchlorid, Ammoniumacetat, Eisen(III)-chlorid
2. Deutung mithilfe der Brönsted-Theorie
3. Berechnung der pH-Werte für c = 0,1 mol/l
Protokoll (Merle M.): Chemieprotokoll14-06-16

von links nach rechts: Natriumchlorid, Natriumacetat, Ammoniumchlorid, Ammoniumacetat, Eisen(III)-chlorid
2. Deutung mithilfe der Brönsted-Theorie
3. Berechnung der pH-Werte für c = 0,1 mol/l
Protokoll (Merle M.): Chemieprotokoll14-06-16
Chemie-Projekttag
08/06/16 16:00
1. Projekt 1:
Redoxtitration -> Iodometrie -> Bestimmung von schwefliger Säure in Weißwein
– Vorversuch: Titration von Iod-Lösung mit Thiosulfat-Lösung



50 mL Iod-Lösung (c = 0,025 mol/L) wird mit Thiosulfat-Lösung titriert bis die Iod-Farbe fast verschwindet, dann Zugabe von 1 mL Stärke-Lösung (2 %) und weitertitriert bis zur Entfärbung.
– Hauptversuch: Bestimmung der schwefligen Säure in Weißwein nach dem Rücktitrationsverfahren


50 mL Weißwein + 50 mL Schwefelsäure (c = 0,5 mol/L) + Überschuss an Iod-Lösung: V(I2) = 10 mL, c(I2)= 0,025 mol/L + 1 mL Stärkelösung (2 %); Titration mit Thiosulfat-Lösung bis zur Entfärbung
– Lewis-Formeln des Sulfat-Ions, des Thiosulfat-Ions, des Sulfid-Ions + Bestimmung der Oxidationszahlen der Schwefelatome
Protokoll (Chiara): Chemieprotokoll08-06-16A
2. Projekt 2:
Von der Silberkonzentrationszelle zur pH-Einstab-Messkette
– Messungen an der Silberkonzentrationszelle: c (Ag+) = 0,01; 0,001; 0,0001 mol/L gegen c(Ag+) = 0,1 mol/L
– Deutung: Elektrochemische Gleichgewichte an den Ag/Ag+-Elektroden -> Konzentrationsabhängigkeit des Elektrodenpotenzials
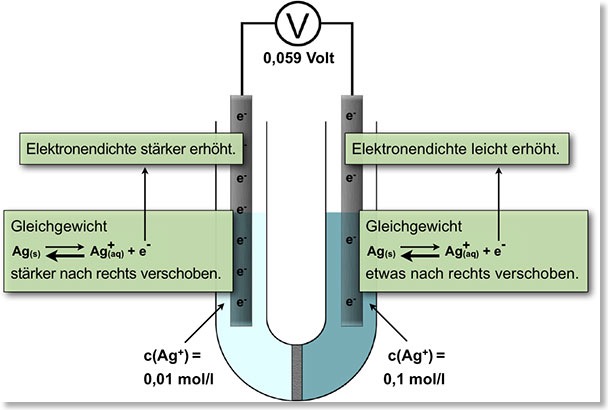
– Nernst-Gleichung: Berechnung des Elektrodenpotenzials in Abhängigkeit von der Konzentration des Metall-Ions
– Übertragung auf alle Redoxsysteme -> wichtiges Beispiel: pH-Abhängigkeit des Elektrodenpotenzials -> Änderung des Elektrodenpotenzials des Redoxpaares (H2/H+) in Abhängigkeit vom pH-Wert (pH = 0, 7, 14, Elektrodenpotenziale: siehe Tafelwerk)
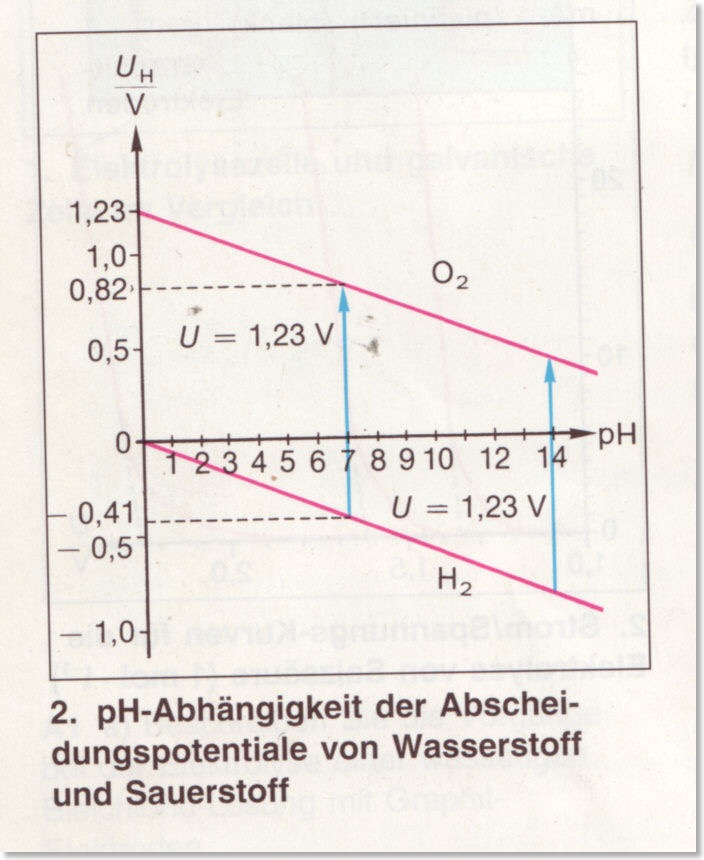
– Wichtige Anwendung: pH-Einstab-Messkette

Protokoll (Fred): Chemieprotokoll08-06-16B
Redoxtitration -> Iodometrie -> Bestimmung von schwefliger Säure in Weißwein
– Vorversuch: Titration von Iod-Lösung mit Thiosulfat-Lösung



50 mL Iod-Lösung (c = 0,025 mol/L) wird mit Thiosulfat-Lösung titriert bis die Iod-Farbe fast verschwindet, dann Zugabe von 1 mL Stärke-Lösung (2 %) und weitertitriert bis zur Entfärbung.
– Hauptversuch: Bestimmung der schwefligen Säure in Weißwein nach dem Rücktitrationsverfahren


50 mL Weißwein + 50 mL Schwefelsäure (c = 0,5 mol/L) + Überschuss an Iod-Lösung: V(I2) = 10 mL, c(I2)= 0,025 mol/L + 1 mL Stärkelösung (2 %); Titration mit Thiosulfat-Lösung bis zur Entfärbung
– Lewis-Formeln des Sulfat-Ions, des Thiosulfat-Ions, des Sulfid-Ions + Bestimmung der Oxidationszahlen der Schwefelatome
Protokoll (Chiara): Chemieprotokoll08-06-16A
2. Projekt 2:
Von der Silberkonzentrationszelle zur pH-Einstab-Messkette
– Messungen an der Silberkonzentrationszelle: c (Ag+) = 0,01; 0,001; 0,0001 mol/L gegen c(Ag+) = 0,1 mol/L
– Deutung: Elektrochemische Gleichgewichte an den Ag/Ag+-Elektroden -> Konzentrationsabhängigkeit des Elektrodenpotenzials

– Nernst-Gleichung: Berechnung des Elektrodenpotenzials in Abhängigkeit von der Konzentration des Metall-Ions
– Übertragung auf alle Redoxsysteme -> wichtiges Beispiel: pH-Abhängigkeit des Elektrodenpotenzials -> Änderung des Elektrodenpotenzials des Redoxpaares (H2/H+) in Abhängigkeit vom pH-Wert (pH = 0, 7, 14, Elektrodenpotenziale: siehe Tafelwerk)

– Wichtige Anwendung: pH-Einstab-Messkette

Protokoll (Fred): Chemieprotokoll08-06-16B
Titration von Cola
06/06/16 14:42
1. Titration von Phosphorsäure in Cola
a) Entscheidung für Messung mit dem pH-Meter (statt Entfärbung mit Aktivkohle oder durch Reaktion mit Milch)
b) Vorgelagert: Erhitzen, um Kohlensäure zu entfernen.
c) Aufnahme der Titrationskurve (Probelösung V(Cola) = 50 mL; Maßlösung c(NaOH) = 0,1 mol/L)
d) Auswertung: 3,5 mL bis zum ersten pH-Sprung (1. Äquivalenzpunkt) -> c(H3PO4) = 0,007 mol/L -> 0,07 % Phosphorsäure (700 mg pro Liter Cola)

2. Besprechung des Verlaufs der Titrationskurve von Phosphorsäure -> Arbeitsblatt
3. Anwendung auf die Titrationskurve von Kohlensäure -> Arbeitsblatt
Protokoll (Lisbeth):
a) Entscheidung für Messung mit dem pH-Meter (statt Entfärbung mit Aktivkohle oder durch Reaktion mit Milch)
b) Vorgelagert: Erhitzen, um Kohlensäure zu entfernen.
c) Aufnahme der Titrationskurve (Probelösung V(Cola) = 50 mL; Maßlösung c(NaOH) = 0,1 mol/L)
d) Auswertung: 3,5 mL bis zum ersten pH-Sprung (1. Äquivalenzpunkt) -> c(H3PO4) = 0,007 mol/L -> 0,07 % Phosphorsäure (700 mg pro Liter Cola)

2. Besprechung des Verlaufs der Titrationskurve von Phosphorsäure -> Arbeitsblatt
3. Anwendung auf die Titrationskurve von Kohlensäure -> Arbeitsblatt
Protokoll (Lisbeth):
Puffer II
01/06/16 16:41
1. Experiment zur Wirkung des Essigsäure-Acetat-Puffers
a) ohne Puffer
– (Leitungs-)Wasser (Achtung: nicht neutral!)

– (Leitungs-)Wasser + Säure

– (Leitungs-)Wasser + Base

b) Essigsäure-Acetat-Puffer
– nur Puffer

– Puffer + Säure

– Puffer + Base

2. Überblick: wichtige Puffersysteme (2 verschiedene Kohlensäure-Puffer und 3 verschieden Phosphorsäure-Puffer)
3. Überblick zu typischen Puffer-Aufgaben (s. auch Aufgabe 3 der Klausur vom 25.05.): Anwendungen zur Henderson-Hasselbalch-Gleichung
a) Berechnung des Wirkungsbereichs eines Puffers
+ Berechnung der Zusammensetzung eines Puffers mit vorgegebenem pH-Wert
b) Reaktionsgleichung für Säure- bzw. Base-"Angriff"
+ Berechnung des pH-Werts nach einem Säure- bzw. Base-"Angriff"
Protokoll (Mareike): Chemieprotokoll 01-06-16
a) ohne Puffer
– (Leitungs-)Wasser (Achtung: nicht neutral!)

– (Leitungs-)Wasser + Säure

– (Leitungs-)Wasser + Base

b) Essigsäure-Acetat-Puffer
– nur Puffer

– Puffer + Säure

– Puffer + Base

2. Überblick: wichtige Puffersysteme (2 verschiedene Kohlensäure-Puffer und 3 verschieden Phosphorsäure-Puffer)
3. Überblick zu typischen Puffer-Aufgaben (s. auch Aufgabe 3 der Klausur vom 25.05.): Anwendungen zur Henderson-Hasselbalch-Gleichung
a) Berechnung des Wirkungsbereichs eines Puffers
+ Berechnung der Zusammensetzung eines Puffers mit vorgegebenem pH-Wert
b) Reaktionsgleichung für Säure- bzw. Base-"Angriff"
+ Berechnung des pH-Werts nach einem Säure- bzw. Base-"Angriff"
Protokoll (Mareike): Chemieprotokoll 01-06-16