October 2016
Abitur-Experimente
28/10/16 16:41
1. Versuch: Titration einer unbekannten organischen Säure (gegeben Massenkonzentration 12 g/L)


– Bestimmung der molaren Masse M der organischen Säure aus dem bis zum Äquivalenzpunkt benötigten Volumen an Natronlauge (Maßlösung: c = 0,1 mol/L; Indikator: Bromthymolblau)
– Bestimmung des pKs-Werts der unbekannten organischen Säure über das Halb-Titrations-Verfahren: Der pH-Wert beim Halbäquivalenzpunkt entspricht dem gesuchten pKs-Wert (siehe Henderson-Hasselbalch-Gleichung).
– Der Vergleich mit Tabellenwerten organischer Säuren (M, pKs) liefert die unbekannte Säure: Ethansäure.
2. Versuch: Eigenschaften von Wasserstoffperoxid (H2O2)
– Zerfall von Wasserstoffperoxid: 2 H2O2 -> 2 H2O + O2 (Beobachtung: feine Gasbläschen steigen auf)
Achtung! In Peroxiden hat Sauerstoff die Oxidationszahl -I
Beim Zerfall findet sowohl eine Oxidation (zu O2), als auch eine Reduktion des Sauerstoff-Atoms (zu H2O) des Wasserstoffperoxids statt. Man spricht von einer Disproportionierung.
Wasserstoffperoxid ist metastabil: Es zerfällt erst beim Erhitzen bzw. in Gegenwart von Katalysatoren.
– Wasserstoffperoxid als Oxidationsmittel
Hier wird Iodid zu Iod oxidiert. Gleichgewichtsverschiebung durch Säure (links). Nachweis mit Stärke (rechts).
Wasserstoffperoxid wird reduziert: H2O2 + 2 H+ + 2 e- -> 2 H2O


– Wasserstoffperoxid als Reduktionsmittel
Hier in der Fehling-Reaktion: Cu(II) wird zu Cu(I) reduziert.
Wasserstoffperoxid wird oxidiert: H2O2 + 2 (OH)- -> O2 + 2 H2O + 2e- (Nachweis von Sauerstoff über die Glimmspanprobe (Mitte); rotbraunes Cu2O (rechts))





– Bestimmung der molaren Masse M der organischen Säure aus dem bis zum Äquivalenzpunkt benötigten Volumen an Natronlauge (Maßlösung: c = 0,1 mol/L; Indikator: Bromthymolblau)
– Bestimmung des pKs-Werts der unbekannten organischen Säure über das Halb-Titrations-Verfahren: Der pH-Wert beim Halbäquivalenzpunkt entspricht dem gesuchten pKs-Wert (siehe Henderson-Hasselbalch-Gleichung).
– Der Vergleich mit Tabellenwerten organischer Säuren (M, pKs) liefert die unbekannte Säure: Ethansäure.
2. Versuch: Eigenschaften von Wasserstoffperoxid (H2O2)
– Zerfall von Wasserstoffperoxid: 2 H2O2 -> 2 H2O + O2 (Beobachtung: feine Gasbläschen steigen auf)
Achtung! In Peroxiden hat Sauerstoff die Oxidationszahl -I
Beim Zerfall findet sowohl eine Oxidation (zu O2), als auch eine Reduktion des Sauerstoff-Atoms (zu H2O) des Wasserstoffperoxids statt. Man spricht von einer Disproportionierung.
Wasserstoffperoxid ist metastabil: Es zerfällt erst beim Erhitzen bzw. in Gegenwart von Katalysatoren.
– Wasserstoffperoxid als Oxidationsmittel
Hier wird Iodid zu Iod oxidiert. Gleichgewichtsverschiebung durch Säure (links). Nachweis mit Stärke (rechts).
Wasserstoffperoxid wird reduziert: H2O2 + 2 H+ + 2 e- -> 2 H2O


– Wasserstoffperoxid als Reduktionsmittel
Hier in der Fehling-Reaktion: Cu(II) wird zu Cu(I) reduziert.
Wasserstoffperoxid wird oxidiert: H2O2 + 2 (OH)- -> O2 + 2 H2O + 2e- (Nachweis von Sauerstoff über die Glimmspanprobe (Mitte); rotbraunes Cu2O (rechts))



Die elektrophile Addition II
26/10/16 17:07
1. Der Mechanismus der elektrophilen Addition
– Polarisierung der Br–Br-Bindung -> Heterolyse: Br+ und Br-
– Addition des Elektrophils (Br+) -> Carbenium-Ion (alternativ: Bromonium-Ion)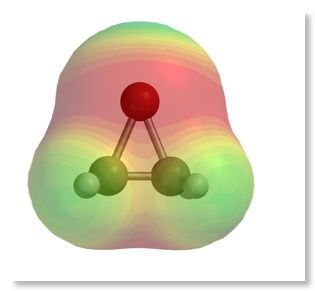
– Rückseitenangriff des Br- -> Dibromalkan
2. Versuch: Nachweis von C=C-Doppelbindungen mit Bromwasser
a) Vergleich Hexan/Hexen
b) Nachweis ungesättigter Fettsäuren im Speiseöl

Achtung: Die beiden Bechergläser Hexan bzw. Hexen müssen getauscht werden, s. u.), also von links nach rechts: Speiseöl, Hexen, Hexan.

3. Weitere Beispiele für elektrophile Additionen an C=C-Doppelbindungen
– säurekatalysierte Addition von Wasser -> Alkanol (Hydroxy-Gruppe)
– Addition von Halogenwasserstoff (HI, HBr, HCl) -> Halogenalkan
Protokoll (Felix):Chemieprotokoll26-10-16
– Polarisierung der Br–Br-Bindung -> Heterolyse: Br+ und Br-
– Addition des Elektrophils (Br+) -> Carbenium-Ion (alternativ: Bromonium-Ion)

– Rückseitenangriff des Br- -> Dibromalkan
2. Versuch: Nachweis von C=C-Doppelbindungen mit Bromwasser
a) Vergleich Hexan/Hexen
b) Nachweis ungesättigter Fettsäuren im Speiseöl

Achtung: Die beiden Bechergläser Hexan bzw. Hexen müssen getauscht werden, s. u.), also von links nach rechts: Speiseöl, Hexen, Hexan.

3. Weitere Beispiele für elektrophile Additionen an C=C-Doppelbindungen
– säurekatalysierte Addition von Wasser -> Alkanol (Hydroxy-Gruppe)
– Addition von Halogenwasserstoff (HI, HBr, HCl) -> Halogenalkan
Protokoll (Felix):Chemieprotokoll26-10-16
Die elektrophile Addition I
21/10/16 15:23
1. Versuch: Reaktion von Ethen mit Bromwasser
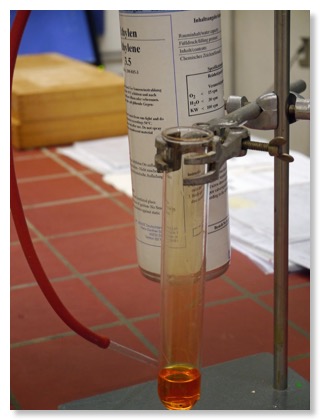


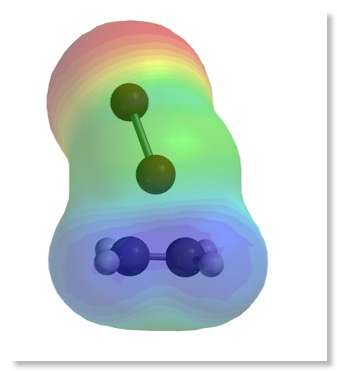
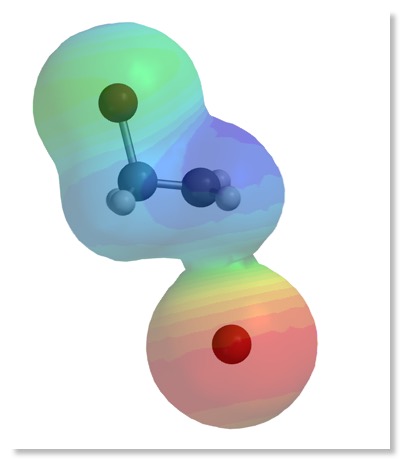
2. Darstellung der Reaktion mit Molekülmodellen

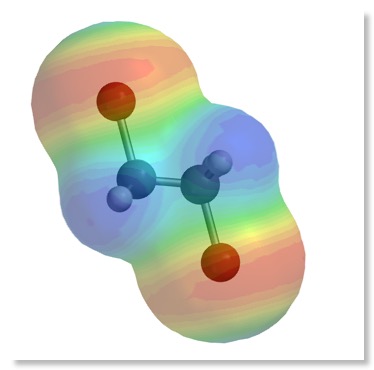
3. Arbeitsblatt: Die elektrophile Addition – Reaktionsmechanismus Ae
Protokoll (Tekla): Chemieprotokoll21-10-16 Ae2 Ae1



2. Darstellung der Reaktion mit Molekülmodellen




3. Arbeitsblatt: Die elektrophile Addition – Reaktionsmechanismus Ae
Protokoll (Tekla): Chemieprotokoll21-10-16 Ae2 Ae1