chemisches Rechnen II: schwache Säuren – pH und pKs
24/02/17 17:15
1. Besprechung der Hausaufgabe: pH, c(H+), LEWIS-Formeln
– Kohlensäure (2-protonig!)
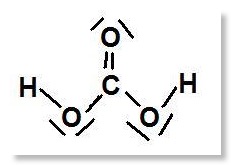
– Schwefelsäure {2-protonig!)

Hinweis: Die Oktettregel muss beim S-Atom nicht erfüllt sein!
2. Besprechung der Hausaufgabe: Titrationskurven (Salzsäure (starke Säure: vollständige Dissoziation)) im Vergleich mit Essigsäure (schwache Säure: unvollständige Dissoziation))
– Vergleich des Kurvenverlaufs:
starke Säure: gleichmäßiger schwacher Anstieg bis zum pH-Sprung, danach wieder gleichmäßiger schwacher Anstieg
schwache Säure: zuerst steiler Anstieg, dann fast waagerechter Bereich, dann ebenfalls pH-Sprung, danach gleichmäßiger schwacher Anstieg
– Anfangspunkt
starke Säure (vollständige Dissoziation): pH = -log(c0(H+))
schwache Säure (unvollständige Dissoziation): pH = 0,5 * (pKS -log(c0(Säure)); c0: Anfangskonzentration
– Äquivalenzpunkt (gleiche Stoffmengen an Säure wie Base: n(H+) = n(OH-)
starke Säure: Neutralpunkt -> pH = 7
schwache Säure: Die Säure ist zu 100 % in die korrespondierende Base (Ac-) umgewandelt worden. Diese Lösung reagiert im Gegensatz zum bei der Titration der starken Säure gebildeten Salz alkalisch! Ursache ist das Protolysegleichgewicht.
pOH = 0,5 * (pKB + log(c0(Base)) -> pH = 14 - pOH
– Halbäquivalenzpunkt: siehe Protokoll 27.02.17
– Kohlensäure (2-protonig!)

– Schwefelsäure {2-protonig!)

Hinweis: Die Oktettregel muss beim S-Atom nicht erfüllt sein!
2. Besprechung der Hausaufgabe: Titrationskurven (Salzsäure (starke Säure: vollständige Dissoziation)) im Vergleich mit Essigsäure (schwache Säure: unvollständige Dissoziation))
– Vergleich des Kurvenverlaufs:
starke Säure: gleichmäßiger schwacher Anstieg bis zum pH-Sprung, danach wieder gleichmäßiger schwacher Anstieg
schwache Säure: zuerst steiler Anstieg, dann fast waagerechter Bereich, dann ebenfalls pH-Sprung, danach gleichmäßiger schwacher Anstieg
– Anfangspunkt
starke Säure (vollständige Dissoziation): pH = -log(c0(H+))
schwache Säure (unvollständige Dissoziation): pH = 0,5 * (pKS -log(c0(Säure)); c0: Anfangskonzentration
– Äquivalenzpunkt (gleiche Stoffmengen an Säure wie Base: n(H+) = n(OH-)
starke Säure: Neutralpunkt -> pH = 7
schwache Säure: Die Säure ist zu 100 % in die korrespondierende Base (Ac-) umgewandelt worden. Diese Lösung reagiert im Gegensatz zum bei der Titration der starken Säure gebildeten Salz alkalisch! Ursache ist das Protolysegleichgewicht.
pOH = 0,5 * (pKB + log(c0(Base)) -> pH = 14 - pOH
– Halbäquivalenzpunkt: siehe Protokoll 27.02.17

