February 2016
Expert/innen: Batterien und Akkus
24/02/16 19:54
Station 1: Alkali-Mangan-Batterie ExpertenBatterien1 AlkaliManganBatterie
Station 2: Zink-Luft-Batterie ExpertenBatterien2 Knopfzellen
Station 3: Blei-Akku ExpertenBatterien3 Autobatterie
Station 4: Lithium-Ionen-Akku ExpertenBatterien4 Li-Metall-Batterie
Station 2: Zink-Luft-Batterie ExpertenBatterien2 Knopfzellen
Station 3: Blei-Akku ExpertenBatterien3 Autobatterie
Station 4: Lithium-Ionen-Akku ExpertenBatterien4 Li-Metall-Batterie
Forschungsauftrag III
23/02/16 17:31
1. Hausaufgabe: Aufstellen von Teilgleichungen und Gesamtgleichung der Redoxreaktion von NAD+ (saures Medium) mit Ethanol, Produkte: NADH, Ethanal
Neue Hausaufgabe: Die WC-Katastrophe – eine spezielle Redoxreaktion

2. Forschungsauftrag III: die Theorie
Neue Hausaufgabe: Die WC-Katastrophe – eine spezielle Redoxreaktion

2. Forschungsauftrag III: die Theorie
Forschungsauftag II
17/02/16 17:27
Forschungsauftrag II: die praktische Arbeit
Gruppe (Fred, Maddy, Ole): Coladose
zu Beginn:

nach einigen Tagen: Veränderungen in Deckel bzw. Boden


Gruppe (Angelo, Christof, Felix, Leon): Konservendose
Die offene Dose rostet:

Nachweis von Fe(II) als Berliner Blau:

Eisennagel: Nachweis von Fe(II)

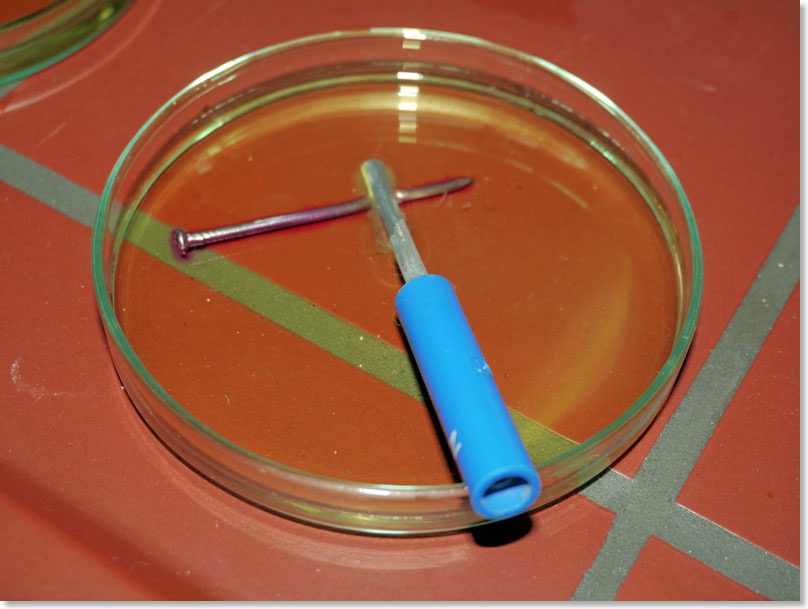
Eisennagel mit Zinkstab: Nachweis von Hydroxid-Ionen
Gruppe (Gemma, Mareike, Max, Merle M., Nila, Tekla): Silberbesteck reinigen

Gruppe (Chiara, Jan, Lisbeth, Merle S.): Kupferplatine ätzen

Das Produkt:

Gruppe (Fred, Maddy, Ole): Coladose
zu Beginn:

nach einigen Tagen: Veränderungen in Deckel bzw. Boden


Gruppe (Angelo, Christof, Felix, Leon): Konservendose
Die offene Dose rostet:

Nachweis von Fe(II) als Berliner Blau:

Eisennagel: Nachweis von Fe(II)

Eisennagel mit Zinkstab: Nachweis von Hydroxid-Ionen

Gruppe (Gemma, Mareike, Max, Merle M., Nila, Tekla): Silberbesteck reinigen

Gruppe (Chiara, Jan, Lisbeth, Merle S.): Kupferplatine ätzen

Das Produkt:

Forschungsauftrag I
16/02/16 17:56
1. Besprechung der Hausaufgabe:
– Aufstellen von Teilgleichungen und Gesamtgleichung der Redoxreaktion von Kaliumpermanganat (saures Medium) mit Oxalsäure
– Arbeitsblatt/Übersicht: Oxidationszahlen von organischen Verbindungen
Neue Hausaufgabe: Aufstellen von Teilgleichungen und Gesamtgleichung der Redoxreaktion von NAD+ (saures Medium) mit Ethanol, Produkte: NADH, Ethanal


2. Auswertung der Versuche zur Standardwasserstoffelektrode vom 10.02.
– Skizze zur Standardwasserstoff-Halbzelle
– Unterschied zwischen Elektrodenpotenzial und Spannung
– Spannungsdiagramm: eine übersichtliche Ausgangsbasis zur Bearbeitung von Fragestellungen zu Redoxreaktionen (Batterien, Elektrolysen …)
Protokoll (Angelo): Chemieprotokoll16-02-16
3. Forschungsaufträge: Gruppeneinteilung
Gruppe (Fred, Maddy, Ole): Coladose ForschungsauftragColadose
Gruppe (Angelo, Christof, Felix, Leon): Konservendose ForschungsauftragKonservendose
Gruppe (Gemma, Mareike, Max, Merle M., Nila, Tekla): Silberbesteck reinigen ForschungsauftragSilberreiniger
Gruppe (Chiara, Jan, Lisbeth, Merle S.): Kupferplatine ätzen ForschungsauftragPlatine
– Aufstellen von Teilgleichungen und Gesamtgleichung der Redoxreaktion von Kaliumpermanganat (saures Medium) mit Oxalsäure
– Arbeitsblatt/Übersicht: Oxidationszahlen von organischen Verbindungen
Neue Hausaufgabe: Aufstellen von Teilgleichungen und Gesamtgleichung der Redoxreaktion von NAD+ (saures Medium) mit Ethanol, Produkte: NADH, Ethanal


2. Auswertung der Versuche zur Standardwasserstoffelektrode vom 10.02.
– Skizze zur Standardwasserstoff-Halbzelle
– Unterschied zwischen Elektrodenpotenzial und Spannung
– Spannungsdiagramm: eine übersichtliche Ausgangsbasis zur Bearbeitung von Fragestellungen zu Redoxreaktionen (Batterien, Elektrolysen …)
Protokoll (Angelo): Chemieprotokoll16-02-16
3. Forschungsaufträge: Gruppeneinteilung
Gruppe (Fred, Maddy, Ole): Coladose ForschungsauftragColadose
Gruppe (Angelo, Christof, Felix, Leon): Konservendose ForschungsauftragKonservendose
Gruppe (Gemma, Mareike, Max, Merle M., Nila, Tekla): Silberbesteck reinigen ForschungsauftragSilberreiniger
Gruppe (Chiara, Jan, Lisbeth, Merle S.): Kupferplatine ätzen ForschungsauftragPlatine
Die Standardwasserstoffelektrode
10/02/16 19:48
1. Hausaufgabe: Arbeitsblatt: Oxidationszahlen bei organischen Verbindungen Oxidationszahlen
2. Auswertung des Versuchs vom 09.02.: Zink-Kupfer-Batterie (Daniell-Element)
– Teilreaktionen an den beiden Elektroden
– Ausbildung der elektrochemischen Doppelschicht: siehe Buch Seite 182
und https://www.youtube.com/watch?v=U0CjN5lnSt0
3. Die Standardwasserstoffelektrode als Bezugselektrode für Standardelektrodenpotenziale
Standardbedingungen: 25 °C, 1013 hPa, Konzentrationen: 1 mol/L
a) Durch Elektrolyse von Salzsäure (c =1 mol/l) mit Pt-Elektroden entsteht eine einfache Standardwasserstoffelektrode.

b) Messung des Standardelektrodenpotenzials der Cu-Elektrode gegen diese einfache Standardwasserstoffelektrode (links)

c) Messung des Standardelektrodenpotenzials der Zn-Elektrode gegen diese einfache Standardwasserstoffelektrode (links)

Protokoll (Maddy): Chemieprotokoll10-02-16
2. Auswertung des Versuchs vom 09.02.: Zink-Kupfer-Batterie (Daniell-Element)
– Teilreaktionen an den beiden Elektroden
– Ausbildung der elektrochemischen Doppelschicht: siehe Buch Seite 182
und https://www.youtube.com/watch?v=U0CjN5lnSt0
3. Die Standardwasserstoffelektrode als Bezugselektrode für Standardelektrodenpotenziale
Standardbedingungen: 25 °C, 1013 hPa, Konzentrationen: 1 mol/L
a) Durch Elektrolyse von Salzsäure (c =1 mol/l) mit Pt-Elektroden entsteht eine einfache Standardwasserstoffelektrode.

b) Messung des Standardelektrodenpotenzials der Cu-Elektrode gegen diese einfache Standardwasserstoffelektrode (links)

c) Messung des Standardelektrodenpotenzials der Zn-Elektrode gegen diese einfache Standardwasserstoffelektrode (links)

Protokoll (Maddy): Chemieprotokoll10-02-16
Zink-Kupfer-Batterie
09/02/16 18:04
1. Besprechung der Hausaufgabe: Aufstellen von Teilgleichungen und Gesamtgleichung der Redoxreaktion von Kaliumpermanganat (saures Medium) mit Ethanol
– Ausführliches Vorgehen beim Ermitteln der Oxidationszahlen in Molekülen, ausgehend von der Elektronegativität der Atome.
– Regeln zum schnellen Ermitteln von Oxidationszahlen.
– Tipps zum Ausgleichen der Teilgleichungen
2. Hausaufgabe:
Beispiel 3: Reaktion von Kaliumpermanganat (angesäuert) mit Oxalsäure
3. Aufbau des Daniell-Elements/der galvanischen Zelle: "Zink-Kupfer-Batterie"

Mit größerer Elektrodenfläche und leistungsfähigerem Diaphragma: Die Batterie treibt einen Propeller an.

Protokoll (Felix): Chemieprotokoll 09-02-16
– Ausführliches Vorgehen beim Ermitteln der Oxidationszahlen in Molekülen, ausgehend von der Elektronegativität der Atome.
– Regeln zum schnellen Ermitteln von Oxidationszahlen.
– Tipps zum Ausgleichen der Teilgleichungen
2. Hausaufgabe:
Beispiel 3: Reaktion von Kaliumpermanganat (angesäuert) mit Oxalsäure
3. Aufbau des Daniell-Elements/der galvanischen Zelle: "Zink-Kupfer-Batterie"

Mit größerer Elektrodenfläche und leistungsfähigerem Diaphragma: Die Batterie treibt einen Propeller an.

Protokoll (Felix): Chemieprotokoll 09-02-16
Batterie – selbst gebaut
03/02/16 17:01
1. Besprechung der Hausaufgabe: Aufstellen von Teilgleichungen und Gesamtgleichung der Redoxreaktion von CuO mit Ethanol
– Ausführliches Vorgehen beim Ermitteln der Oxidationszahlen in Molekülen, ausgehend von der Elektronegativität der Atome.
– Regeln zum schnellen Ermitteln von Oxidationszahlen.
2. Hausaufgabe:
Beispiel 2: Reaktion von Kaliumpermanganat (angesäuert) mit Ethanol
3. Die Obstbatterie: Wie erreicht man überhaupt eine Spannung bzw. eine möglichst hohe Spannung?
"Obst": Zitrone, Apfel und Kartoffel
Metalle: Eisen, Zink, Silber, Kupfer

Protokoll (Chiara): Chemieprotokoll03-02-16
– Ausführliches Vorgehen beim Ermitteln der Oxidationszahlen in Molekülen, ausgehend von der Elektronegativität der Atome.
– Regeln zum schnellen Ermitteln von Oxidationszahlen.
2. Hausaufgabe:
Beispiel 2: Reaktion von Kaliumpermanganat (angesäuert) mit Ethanol
3. Die Obstbatterie: Wie erreicht man überhaupt eine Spannung bzw. eine möglichst hohe Spannung?
"Obst": Zitrone, Apfel und Kartoffel
Metalle: Eisen, Zink, Silber, Kupfer

Protokoll (Chiara): Chemieprotokoll03-02-16
Redoxreaktion und Oxidationszahl
02/02/16 17:33
1. Übersicht: Themenbereiche der Chemie ÜbersichtChemieSekII
2. Reaktion Magnesium/Sauerstoff


3. Reaktion Magnesium/Iod

4. Verallgemeinerung von Redoxraktionen als Elektronenübertragungsreaktionen: Donator-Akzeptor-Prinzip
5. Reaktion Ethanol/CuO: Redoxreaktionen mit Molekülen


6. Hausaufgabe: Oxidationszahlen (siehe Buch Seiten 172, 173)
Protokoll (Mareike): Chemieprotokoll02-02-16
2. Reaktion Magnesium/Sauerstoff


3. Reaktion Magnesium/Iod

4. Verallgemeinerung von Redoxraktionen als Elektronenübertragungsreaktionen: Donator-Akzeptor-Prinzip
5. Reaktion Ethanol/CuO: Redoxreaktionen mit Molekülen


6. Hausaufgabe: Oxidationszahlen (siehe Buch Seiten 172, 173)
Protokoll (Mareike): Chemieprotokoll02-02-16