Abitur
05/04/17 18:10
Aufgabe Stickstoffverbindungen
1. Energetik: Enthalpieberechnungen, Gibbs-Helmholtz-Gleichung, Bewertung
2. Säure-Base-Reaktion: Prinzip vom kleinsten Zwang, Brönsted-Theorie (HNO3), Struktur-Eigenschafts-Beziehung (HNO3/HNO2), Titrationskurve HNO2
3. Redoxreaktion: Indigo-Färben, Redoxreaktion Leuko-Indigo/Indigo, Struktur-Eigenschafts-Beziehung, Fehling-/Silberspiegel-Probe
Experimentier-Aufgabe Ascorbinsäure
1. Ascorbinsäure als Reduktionsmittel
– Experimente/Deutung
a) Fe(II) + gelbes Blutlaugensalz/Fe(III) + gelbes Blutlaugensalz
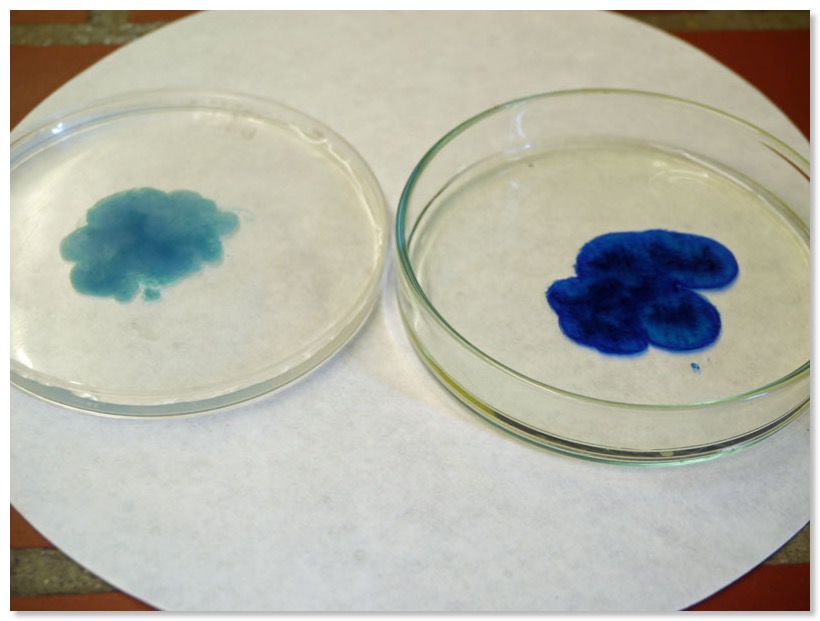
b) Ascorbinsäure zutropfen
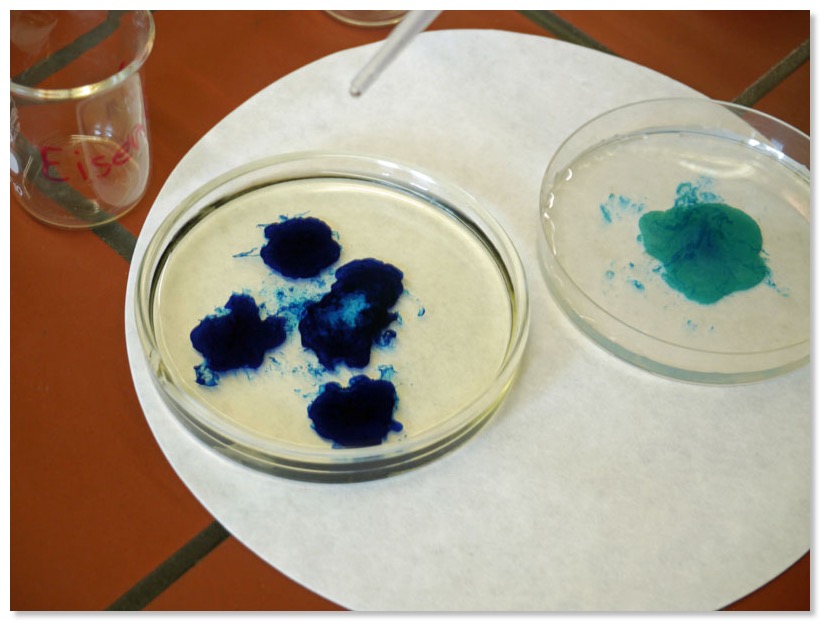
– Redox-Begriff
2. Ascorbinsäure als Brönsted-Säure
– Experimente/Deutung
a) Ascorbinsäure + Magnesiumpulver

b) Ascorbinsäure-Titration: mit Natronlauge, Universalindikator


– Titration
– Struktur-Eigenschafts-Beziehung
– Tipp
1. Energetik: Enthalpieberechnungen, Gibbs-Helmholtz-Gleichung, Bewertung
2. Säure-Base-Reaktion: Prinzip vom kleinsten Zwang, Brönsted-Theorie (HNO3), Struktur-Eigenschafts-Beziehung (HNO3/HNO2), Titrationskurve HNO2
3. Redoxreaktion: Indigo-Färben, Redoxreaktion Leuko-Indigo/Indigo, Struktur-Eigenschafts-Beziehung, Fehling-/Silberspiegel-Probe
Experimentier-Aufgabe Ascorbinsäure
1. Ascorbinsäure als Reduktionsmittel
– Experimente/Deutung
a) Fe(II) + gelbes Blutlaugensalz/Fe(III) + gelbes Blutlaugensalz

b) Ascorbinsäure zutropfen

– Redox-Begriff
2. Ascorbinsäure als Brönsted-Säure
– Experimente/Deutung
a) Ascorbinsäure + Magnesiumpulver

b) Ascorbinsäure-Titration: mit Natronlauge, Universalindikator


– Titration
– Struktur-Eigenschafts-Beziehung
– Tipp
Reaktionstypen, -mechanismen
22/03/17 18:03
1. organische Reaktionen (Maddy, Tekla): https://prezi.com/nbsgbidyiusc/present/?auth_key=qq9z9s3&follow=k-kauyxiz21v&kw=present-nbsgbidyiusc&rc=ref-235616427
2. Donator-Akzeptor-Reaktionen (Mareike, Max): https://prezi.com/iwnhwmlkshmu/present/?auth_key=5psfj10&follow=vxsyztwtsqqg
2. Donator-Akzeptor-Reaktionen (Mareike, Max): https://prezi.com/iwnhwmlkshmu/present/?auth_key=5psfj10&follow=vxsyztwtsqqg
Nomenklatur/chemisches Rechnen
17/03/17 17:38
1. Nomenklatur (Jan, Merle St.): Nomenklatur
Achtung: Aldehyd-Gruppe (CHO-Gruppe) und Ester-Gruppe (COOR-Gruppe)
2. Übersicht "chemisches Rechnen"
https://prezi.com/qvk30snpp00s/present/?auth_key=3bbpnx9&follow=k-kauyxiz21v&kw=present-qvk30snpp00s&rc=ref-235616427
Powerpoint "chemisches Rechnen" (Fred): Chemische Rechnungen
3. Abituraufgabe: Chemie der Arzneimittel
Aufgabe 1: Sodbrennen
– Reaktionsgleichung Calciumcarbonat mit Salzsäure
– Protolysegleichgewichte (+ Brönsted-Fachbegriffe) von:
Carbonat
Hydrogencarbonat
– Berechnung des pH-Werts einer Carboant-Lösung (schwache Brönsted-Base)
– Verfahren der Rücktitration (Arbeiten mit einem Überschuss an Salzsäure für eine vollständige Umsetzung des Calciumcarbonats; anschließend Titration des Salzsäure-Rests mit Natronlauge)
4. zur Übung:
Abituraufgabe: Chemie des Marathonläufers
Aufgabe 1: Berechnung der Verbrennungsenthalpie von Glucose
Aufgabe 2: Milchsäure
– Protolysegleichgewicht und Säurekonstante
– Struktur-Eigenschafts-Beziehung: Vergleich der pKS-Werte verschiedener organischer Säuren
– pH-Berechnung für schwache Säure
– Henderson-Hasselbalch-Gleichung: Blutpuffer (H2CO3/HCO3-)
Aufgabe 3: Laufschuh
– Elastomer (Gummi/Kautschuk)
– thermoplastisches elastomer (Polyurethan)
– Polykondensation
Achtung: Aldehyd-Gruppe (CHO-Gruppe) und Ester-Gruppe (COOR-Gruppe)
2. Übersicht "chemisches Rechnen"
https://prezi.com/qvk30snpp00s/present/?auth_key=3bbpnx9&follow=k-kauyxiz21v&kw=present-qvk30snpp00s&rc=ref-235616427
Powerpoint "chemisches Rechnen" (Fred): Chemische Rechnungen
3. Abituraufgabe: Chemie der Arzneimittel
Aufgabe 1: Sodbrennen
– Reaktionsgleichung Calciumcarbonat mit Salzsäure
– Protolysegleichgewichte (+ Brönsted-Fachbegriffe) von:
Carbonat
Hydrogencarbonat
– Berechnung des pH-Werts einer Carboant-Lösung (schwache Brönsted-Base)
– Verfahren der Rücktitration (Arbeiten mit einem Überschuss an Salzsäure für eine vollständige Umsetzung des Calciumcarbonats; anschließend Titration des Salzsäure-Rests mit Natronlauge)
4. zur Übung:
Abituraufgabe: Chemie des Marathonläufers
Aufgabe 1: Berechnung der Verbrennungsenthalpie von Glucose
Aufgabe 2: Milchsäure
– Protolysegleichgewicht und Säurekonstante
– Struktur-Eigenschafts-Beziehung: Vergleich der pKS-Werte verschiedener organischer Säuren
– pH-Berechnung für schwache Säure
– Henderson-Hasselbalch-Gleichung: Blutpuffer (H2CO3/HCO3-)
Aufgabe 3: Laufschuh
– Elastomer (Gummi/Kautschuk)
– thermoplastisches elastomer (Polyurethan)
– Polykondensation
Brönsted-Theorie: Titration und Puffer
24/02/17 17:33
Brönsted-Theorie (Chiara, Mareike, Max) Brönsted-Theorie
1. Fachbegriffe der Brönsted-Theorie -> Basiskonzept: Donator-Akzeptor-Reaktionen
2. Anwendung Titrationskurve, Beispiel: 50 mL Ammoniak (c = 0,1 mol/L; Probelösung) werden mit HBr-Lösung (c = 1 mol/L, Maßlösung) titriert.
a) Berechnung der pH-Werte von 4 charakteristischen Punkten der Titrationskurve:
Achtung! In diesem Beispiel liegt der Sonderfall vor, dass eine schwache Base mit einer starken Säure titriert wird (bisher immer umgekehrt!)
– Anfangspunkt: pOH = 0,5 * (pKB - log c(Base, hier NH3)) -> pH
– Halbäquivalenzpunkt: pH = pKS; pKS + pKB = 14
– Äquivalenzpunkt: pH = 0,5 * (pKS - log(korrespondierende Säure, hier NH4+))
– Endpunkt (z. B. 1 mL über den Äquivalenzpunkt hinaus); vereinfachte Abschätzung: Verdünnung der Maßlösung um 1 mL/50 mL -> pH
b) "Konstruktion" der Titrationskurve aus den vier Punkten
c) Beschreibung des typischen Kurvenverlaufs für den Titrations"fall": schwach(Probelösung)/stark(Maßlösung)
3. Anwendung Puffer, Beispiel H2CO3/HCO3- - Puffer (im Speichel)
a) Beschreibung der Pufferzusammensetzung und Pufferwirkung (mit den Fachbegriffen der Brönsted-Theorie)
b) Reaktionsgleichungen:
– für das Abpuffern einer Säure (H3O+)
– für das Abpuffern einer Base (OH-)
c) (Be-)Rechnungen mithilfe der Henderson-Hasselbalch-Gleichung: pH = pKS + log(c(Base, hier HCO3-)/c(Säure, hier H2CO3))
d) wichtige Puffersysteme:
– Kohlensäure-Puffer: Achtung, wegen der 2-Protonigkeit gibt es hier 2 Puffer
– Phosphorsäure: Achtung, wegen der 3-Protonigkeit gibt es hier 3 Puffer
– Essigsäure/Acetat-Puffer
1. Fachbegriffe der Brönsted-Theorie -> Basiskonzept: Donator-Akzeptor-Reaktionen
2. Anwendung Titrationskurve, Beispiel: 50 mL Ammoniak (c = 0,1 mol/L; Probelösung) werden mit HBr-Lösung (c = 1 mol/L, Maßlösung) titriert.
a) Berechnung der pH-Werte von 4 charakteristischen Punkten der Titrationskurve:
Achtung! In diesem Beispiel liegt der Sonderfall vor, dass eine schwache Base mit einer starken Säure titriert wird (bisher immer umgekehrt!)
– Anfangspunkt: pOH = 0,5 * (pKB - log c(Base, hier NH3)) -> pH
– Halbäquivalenzpunkt: pH = pKS; pKS + pKB = 14
– Äquivalenzpunkt: pH = 0,5 * (pKS - log(korrespondierende Säure, hier NH4+))
– Endpunkt (z. B. 1 mL über den Äquivalenzpunkt hinaus); vereinfachte Abschätzung: Verdünnung der Maßlösung um 1 mL/50 mL -> pH
b) "Konstruktion" der Titrationskurve aus den vier Punkten
c) Beschreibung des typischen Kurvenverlaufs für den Titrations"fall": schwach(Probelösung)/stark(Maßlösung)
3. Anwendung Puffer, Beispiel H2CO3/HCO3- - Puffer (im Speichel)
a) Beschreibung der Pufferzusammensetzung und Pufferwirkung (mit den Fachbegriffen der Brönsted-Theorie)
b) Reaktionsgleichungen:
– für das Abpuffern einer Säure (H3O+)
– für das Abpuffern einer Base (OH-)
c) (Be-)Rechnungen mithilfe der Henderson-Hasselbalch-Gleichung: pH = pKS + log(c(Base, hier HCO3-)/c(Säure, hier H2CO3))
d) wichtige Puffersysteme:
– Kohlensäure-Puffer: Achtung, wegen der 2-Protonigkeit gibt es hier 2 Puffer
– Phosphorsäure: Achtung, wegen der 3-Protonigkeit gibt es hier 3 Puffer
– Essigsäure/Acetat-Puffer
Versuche: Elektrolyse – galvanische Zelle
17/02/17 17:01
1. Elektrolyse
– Teil- und Gesamtgleichung für die Elektrolyse von Wasser
– Abituraufgabe: Versuch Elektrolyse von Ammoniumacetat-Lösung (mit Bromthymolblau als Indikator)
zum Start:

nach 5 min:

2. galvanische Zelle
– Aufbau und beschriftete Skizze dazu
– Spezialfall: Konzentrationszelle (Beispiel Kupfer)
Zelldiagramm: Cu2+(c1)/Cu//Cu2+(c2)/Cu
a) Standardbedingungen: c1 = c2 = 1 mol/l -> U = 0 V
b) c1 = 1 mol/l; c2 = 0,1 mol/l -> U = 40 mV

c) Deutung mit dem elektrochemischen Gleichgewicht:
– Die Halbzelle mit der konzentrierten Lösung ist immer der Pluspol -> Elektronen werden von den Cu2+-Ionen aufgenommen, Cu2+-Ionen scheiden sich an der Elektrode ab.
– Die Halbzelle mit der verdünnten Lösung ist immer der Minuspol -> Cu2+-Ionen gehen in Lösung; Elektronen werden an die Elektrode abgegeben.
d) Berechnung des Elektrodenpotenzials mit der Nernstschen Gleichung: Das Elektrodenpotenzial hängt von der Konzentration ab!
e) Arbeitsblatt: Bestimmung des Ionenprodukts von Wasser
– Teil- und Gesamtgleichung für die Elektrolyse von Wasser
– Abituraufgabe: Versuch Elektrolyse von Ammoniumacetat-Lösung (mit Bromthymolblau als Indikator)
zum Start:

nach 5 min:

2. galvanische Zelle
– Aufbau und beschriftete Skizze dazu
– Spezialfall: Konzentrationszelle (Beispiel Kupfer)
Zelldiagramm: Cu2+(c1)/Cu//Cu2+(c2)/Cu
a) Standardbedingungen: c1 = c2 = 1 mol/l -> U = 0 V
b) c1 = 1 mol/l; c2 = 0,1 mol/l -> U = 40 mV

c) Deutung mit dem elektrochemischen Gleichgewicht:
– Die Halbzelle mit der konzentrierten Lösung ist immer der Pluspol -> Elektronen werden von den Cu2+-Ionen aufgenommen, Cu2+-Ionen scheiden sich an der Elektrode ab.
– Die Halbzelle mit der verdünnten Lösung ist immer der Minuspol -> Cu2+-Ionen gehen in Lösung; Elektronen werden an die Elektrode abgegeben.
d) Berechnung des Elektrodenpotenzials mit der Nernstschen Gleichung: Das Elektrodenpotenzial hängt von der Konzentration ab!
e) Arbeitsblatt: Bestimmung des Ionenprodukts von Wasser