August 2016
Reaktionsenthalpie II (Auswertung + Berechnung)
29/08/16 12:28
Teil 1:
1. Neutralisationsenthalpie
– aus dem Experiment (s. 26.08.) berechnet
2. Reaktionsenthalpie einer Redoxreaktion
– aus dem Experiment (s. u.) berechnet
5 g CuSO4*5H2O in 100 ml Wasser

+ 5 g Zn-Pulver

3. Hinweise zum Rechnen mit Größengleichungen:
– n = m/M
– Q = n * DeltaH
– wichtige Größen: Stoffmenge n; Stoffmengenkonzentration c; Masse m; molare Masse M; Volumen V
Protokoll (Lena): ProtokollLena
Teil 2:
3. Standard-Bildungsenthalpien
a) Darstellung im Enthalpiediagramm
b) Arbeiten mit der Tabelle im Tafelwerk (ab S. 132: anorganische Verbindungen; ab S. 135: organische Verbindungen)
Beispiele: H2O(g) und H2O(l); CO2(g)
4. Berechnung von Reaktionsenthalpien mithilfe von Standard-Bildungsenthalpien
a) Beispiel: Verbrennen von Erdgas (Methan)
b) Beispiel: Stearinsäure ("Fett")
5. Physikalischer und physiologischer Brennwert
Protokoll (Karl): ProtokollKarl
1. Neutralisationsenthalpie
– aus dem Experiment (s. 26.08.) berechnet
2. Reaktionsenthalpie einer Redoxreaktion
– aus dem Experiment (s. u.) berechnet
5 g CuSO4*5H2O in 100 ml Wasser

+ 5 g Zn-Pulver

3. Hinweise zum Rechnen mit Größengleichungen:
– n = m/M
– Q = n * DeltaH
– wichtige Größen: Stoffmenge n; Stoffmengenkonzentration c; Masse m; molare Masse M; Volumen V
Protokoll (Lena): ProtokollLena
Teil 2:
3. Standard-Bildungsenthalpien
a) Darstellung im Enthalpiediagramm
b) Arbeiten mit der Tabelle im Tafelwerk (ab S. 132: anorganische Verbindungen; ab S. 135: organische Verbindungen)
Beispiele: H2O(g) und H2O(l); CO2(g)
4. Berechnung von Reaktionsenthalpien mithilfe von Standard-Bildungsenthalpien
a) Beispiel: Verbrennen von Erdgas (Methan)
b) Beispiel: Stearinsäure ("Fett")
5. Physikalischer und physiologischer Brennwert
Protokoll (Karl): ProtokollKarl
Reaktionsenthalpie I (Experiment)
26/08/16 18:02
1. Besprechung der Hausaufgabe: Umrechnung der Verbrennungswärme von Ethanol von kJ/g in kJ/mol
2. Gründe für die starke Abweichung vom Literaturwert
3. Versuch: Bestimmung der Neutralisationsenthalpie
50 mL Salzsäure (1 mol/L), Starttemperatur: 26,8 Grad

schnell Zugabe von 50 mL Natronlauge (1 mol/L)

Endtemperatur: 33,0 Grad; m(Lösung) = 100 g

Protokoll (Tabea): ProtokollTabea
Kalorimetrie II (Auswertung)
19/08/16 17:58
1. Basics (Laura): Reaktionsgleichungen (-> weitere Beispiele als Hausaufgabe)
2. Reaktionsgleichung für die Verbrennung von Ethanol
3. Berechnung der der Verbrennungswärme von Ethanol
a) in kJ pro g
b) in kJ pro mol (als Hausaufgabe)
Protokoll (Jan): ProtokollJan
2. Reaktionsgleichung für die Verbrennung von Ethanol
3. Berechnung der der Verbrennungswärme von Ethanol
a) in kJ pro g
b) in kJ pro mol (als Hausaufgabe)
Protokoll (Jan): ProtokollJan
Kalorimetrie I (Experiment)
15/08/16 17:05
1. Basics (Karl): Das Mol
2. Versuch: Bestimmung der Verbrennungswärme von Alkohol (Ethanol)

Protokoll (Mardjan): ProtokollMardjan
2. Versuch: Bestimmung der Verbrennungswärme von Alkohol (Ethanol)

Protokoll (Mardjan): ProtokollMardjan
Energiegehalt von Chemikalien (Lebensmitteln)
12/08/16 16:25
1. Versuch für Biologie: Wasser – ein Dipol-Molekül


2. Wiederholung (siehe 08.08.):
– Übersicht Kohlenhydrate
– Fischer-Projektion von Glucose
3. Energiegehalt von Chemikalien (Lebensmitteln)
a) Traubenzucker -> Kalorienangabe auf der Verpackung

b) Kalorie -> Kilokalorie -> Kilojoule: 1 cal entspricht der benötigten Wärmemenge, um 1 g Wasser (= 1mL) um 1 Grad aufzuheizen; 1 cal = 4,18 J
c) Energieabgebende Reaktionen: exotherm
-> Beispiel (Einmal-)Wärmekissen 1 (exotherme Reaktion von Eisenpulver mit Luftsauerstoff)

-> Beispiel (regenerierbares) Wärmekissen 2 (exothermer Kristallisationsvorgang)

d) Energieaufnehmende Reaktionen: endotherm
-> Beispiel (Einmal-)Kühlkissen (endothermer Lösungsvorgang)

e) Darstellung im Energiediagramm
Protokoll (Lio): ProtokollLio


2. Wiederholung (siehe 08.08.):
– Übersicht Kohlenhydrate
– Fischer-Projektion von Glucose
3. Energiegehalt von Chemikalien (Lebensmitteln)
a) Traubenzucker -> Kalorienangabe auf der Verpackung

b) Kalorie -> Kilokalorie -> Kilojoule: 1 cal entspricht der benötigten Wärmemenge, um 1 g Wasser (= 1mL) um 1 Grad aufzuheizen; 1 cal = 4,18 J
c) Energieabgebende Reaktionen: exotherm
-> Beispiel (Einmal-)Wärmekissen 1 (exotherme Reaktion von Eisenpulver mit Luftsauerstoff)

-> Beispiel (regenerierbares) Wärmekissen 2 (exothermer Kristallisationsvorgang)

d) Energieaufnehmende Reaktionen: endotherm
-> Beispiel (Einmal-)Kühlkissen (endothermer Lösungsvorgang)

e) Darstellung im Energiediagramm
Protokoll (Lio): ProtokollLio
Übersicht Kohlenhydrate
08/08/16 19:10
1. Versuch: Puderzucker + konzentrierte Schwefelsäure



2. Übersicht Kohlenhydrate:

3. Die Struktur des Glucose-Moleküls
a) Kettenform -> Fischer-Projektion

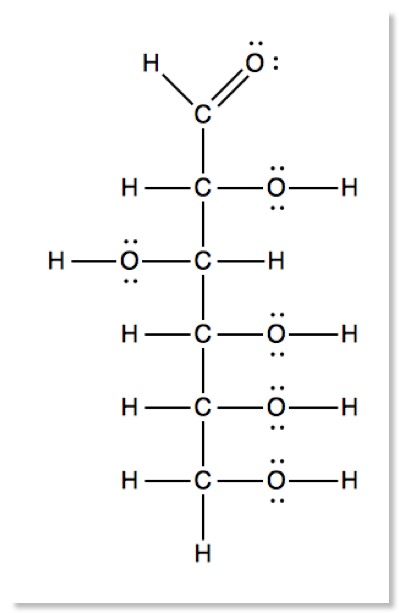
b) Ringform -> Haworth-Projektion





2. Übersicht Kohlenhydrate:

3. Die Struktur des Glucose-Moleküls
a) Kettenform -> Fischer-Projektion


b) Ringform -> Haworth-Projektion


Inhaltsstoffe von Lebensmitteln
05/08/16 18:49
1. Übersicht zu Inhaltsstoffen von Lebensmitteln:

Beispiel: Ü-Ei

Beispiel: Hanuta

Beispiel: Gummibärchen

Beispiel: Kartoffelchips


Beispiel: Ü-Ei

Beispiel: Hanuta

Beispiel: Gummibärchen

Beispiel: Kartoffelchips









