September 2016
Freie Enthalpie
30/09/16 14:57
1. Referat (Philipp): Perpetuum mobile 1. und 2. Art Perpetuum Mobile
Science Slam Exergie/Anergie: https://www.youtube.com/watch?v=qRMnpV5E5J8
2. Freie Enthalpie G: Vorhersage möglich, ob eine Reaktion läuft oder nicht läuft!
3. Berechnungen mit der Gibbs-Helmholtz-Gleichung:
a) Beispiel Erdgas (Methan) verbrennt -> exergonisch (bei Raumtemperatur), aber: endergonisch (über 3700 K)
b) Beispiel Brennstoffzelle: Wasserstoff "verbrennt" nahe am reversiblen Prozess im Gegensatz zur Knallgasreaktion (vollständig irreversibler Prozess).
Daraus ergibt sich ein hoher Wirkungsgrad: nutzbarer Energieanteil (= freie Reaktionsenthalpie) / zugeführte Energie (= Reaktionsenthalpie)
Protokoll (Mercedeh): ProtokollMercedeh
Science Slam Exergie/Anergie: https://www.youtube.com/watch?v=qRMnpV5E5J8
2. Freie Enthalpie G: Vorhersage möglich, ob eine Reaktion läuft oder nicht läuft!
3. Berechnungen mit der Gibbs-Helmholtz-Gleichung:
a) Beispiel Erdgas (Methan) verbrennt -> exergonisch (bei Raumtemperatur), aber: endergonisch (über 3700 K)
b) Beispiel Brennstoffzelle: Wasserstoff "verbrennt" nahe am reversiblen Prozess im Gegensatz zur Knallgasreaktion (vollständig irreversibler Prozess).
Daraus ergibt sich ein hoher Wirkungsgrad: nutzbarer Energieanteil (= freie Reaktionsenthalpie) / zugeführte Energie (= Reaktionsenthalpie)
Protokoll (Mercedeh): ProtokollMercedeh
Entropie II
26/09/16 19:25
1. Science-Slam zur Entropie: https://www.youtube.com/watch?v=z64PJwXy--8
2. Berechnung der Reaktionsenthalpien zu den Lösungsreaktionen vom 23.09.16 -> Enthalpiediagramme
3. Berechnung der Reaktionsentropien zu den Lösungsreaktionen vom 23.09.16
Protokoll (Darleen):
2. Berechnung der Reaktionsenthalpien zu den Lösungsreaktionen vom 23.09.16 -> Enthalpiediagramme
3. Berechnung der Reaktionsentropien zu den Lösungsreaktionen vom 23.09.16
Protokoll (Darleen):
Entropie I
23/09/16 18:17
1. Referat (Darleen): Entropie
2. Versuchsreihe: endotherme Reaktionen I (Lösen von Salzen)

Die Enthalpie der Lösungsreaktion der verschiedenen Salze ergibt sich aus dem Wechselspiel von endothermer Gitterenthalpie (Energiebedarf, um das Gitter aufzulösen) und exothermer Hydratationsenthalpie (Freisetzung von Energie beim Ausbilden der Hydrahülle um die Ionen). Je nachdem, wer "gewinnt", ist die Lösungsreaktion exotherm oder endotherm.
Protokoll (Laura K.): ProtokollLauraK
2. Versuchsreihe: endotherme Reaktionen I (Lösen von Salzen)

Die Enthalpie der Lösungsreaktion der verschiedenen Salze ergibt sich aus dem Wechselspiel von endothermer Gitterenthalpie (Energiebedarf, um das Gitter aufzulösen) und exothermer Hydratationsenthalpie (Freisetzung von Energie beim Ausbilden der Hydrahülle um die Ionen). Je nachdem, wer "gewinnt", ist die Lösungsreaktion exotherm oder endotherm.
Protokoll (Laura K.): ProtokollLauraK
Chemie beim Sport
19/09/16 18:14
1. Referat (Alicia, Laura D.): Chemie beim Sport Bio-Chemie beim Sport
2. Arbeitsblatt: Redoxreaktion mit NAD+/NADH
3. Arbeitsblatt: Oxidationszahlen bei organischen Verbindungen (Hausaufgabe): Oxidationszahlen
2. Arbeitsblatt: Redoxreaktion mit NAD+/NADH
3. Arbeitsblatt: Oxidationszahlen bei organischen Verbindungen (Hausaufgabe): Oxidationszahlen
Alkoholdehydrogenase
16/09/16 17:55
1. Der Weg von Alkohol (Ethanol) durch den Körper
2. Arbeitsblatt: Alkoholdeyhdrogenase (ADH)

http://www.rcsb.org/pdb/explore/explore.do?structureId=1htb
weitere Informationen zur Struktur des Enzyms: http://pdb101.rcsb.org/motm/13
3. Reaktionsverlauf im aktiven Zentrum der AHD: Redoxreaktion mit NAD+/NADH

Protokoll (Paul R):
2. Arbeitsblatt: Alkoholdeyhdrogenase (ADH)

http://www.rcsb.org/pdb/explore/explore.do?structureId=1htb
weitere Informationen zur Struktur des Enzyms: http://pdb101.rcsb.org/motm/13
3. Reaktionsverlauf im aktiven Zentrum der AHD: Redoxreaktion mit NAD+/NADH

Protokoll (Paul R):
Redoxreaktionen II
12/09/16 17:43
1. Besprechung der LZK Energetik (s. 02.09.)
– Operatoren
– Schreibweisen
– Reaktionsgleichung aufstellen
– Berechnen einer Reaktionsenthalpie mit Hilfe der Standardbildungsenthalpien, Beispiel: Verbrennen von Stearinsäure
2. Deutung des Versuchs Ethanol + CuO (s. 09.09.)
– Aufstellen der Reaktionsgleichung
– Zuordnen der Versuchsbeobachtungen
Für das Aufstellen der Reaktionsgleichung werden benötigt:
–> eine neuer (erweiterter) Redoxbegriff
Oxidation: Abgabe von Elektronen
Reduktion: Aufnahme von Elektronen
–> und Oxidationszahlen
Beispiel: Ethanol
3. Hausaufgabe: Oxidationszahlen der Atome im Ethansäure-Molekül
Protokoll (Lotta): ProtokollLotta
– Operatoren
– Schreibweisen
– Reaktionsgleichung aufstellen
– Berechnen einer Reaktionsenthalpie mit Hilfe der Standardbildungsenthalpien, Beispiel: Verbrennen von Stearinsäure
2. Deutung des Versuchs Ethanol + CuO (s. 09.09.)
– Aufstellen der Reaktionsgleichung
– Zuordnen der Versuchsbeobachtungen
Für das Aufstellen der Reaktionsgleichung werden benötigt:
–> eine neuer (erweiterter) Redoxbegriff
Oxidation: Abgabe von Elektronen
Reduktion: Aufnahme von Elektronen
–> und Oxidationszahlen
Beispiel: Ethanol
3. Hausaufgabe: Oxidationszahlen der Atome im Ethansäure-Molekül
Protokoll (Lotta): ProtokollLotta
Redoxreaktionen I
09/09/16 17:25
1. Zusammenfassung zur Bio-Energetik
– Lebensmittel (Kohlenwasserstoffverbindungen) liefern den Energieträger Wasserstoff.
– Als Wasserstoffspeicher dient in den Zellen NADH.
– Die im Wasserstoff gespeicherte Energie wird in vielen kleinen Reaktionsschritten frei gesetzt (statt Knallgasreaktion).
– Als Speicher für diese kleinen Energieportionen dient im Stoffwechsel ATP.
– Der letzte Reaktionsschritt ist die Reaktion mit Sauerstoff zu Wasser.
– Längs der Reaktionskette wandern Elektronen in vielen Redoxreaktionsschritten von einem Niveau mit hoher Energie (in den Lebensmitteln: Kohlenhydrate, Fette und Eiweiße) auf ein Niveau mit niedriger Energie (im Wasser-Molekül).
2. Redoxreaktionen – alte Definition
Oxidation: Aufnahme von Sauerstoff
Reduktion: Abgabe von Sauerstoff
Beispiel: Kupfer reagiert mit Sauerstoff



Beispiel: Kupferoxid reagiert mit Kohlenstoff



3. Redoxreaktion – neue Definition
Oxidation: Abgabe von Elektronen
Reduktion: Aufnahme von Elektronen
Beispiel: Kupferoxid reagiert mit Ethanol


Protokoll (Philipp): ProtokollPhilipp
– Lebensmittel (Kohlenwasserstoffverbindungen) liefern den Energieträger Wasserstoff.
– Als Wasserstoffspeicher dient in den Zellen NADH.
– Die im Wasserstoff gespeicherte Energie wird in vielen kleinen Reaktionsschritten frei gesetzt (statt Knallgasreaktion).
– Als Speicher für diese kleinen Energieportionen dient im Stoffwechsel ATP.
– Der letzte Reaktionsschritt ist die Reaktion mit Sauerstoff zu Wasser.
– Längs der Reaktionskette wandern Elektronen in vielen Redoxreaktionsschritten von einem Niveau mit hoher Energie (in den Lebensmitteln: Kohlenhydrate, Fette und Eiweiße) auf ein Niveau mit niedriger Energie (im Wasser-Molekül).
2. Redoxreaktionen – alte Definition
Oxidation: Aufnahme von Sauerstoff
Reduktion: Abgabe von Sauerstoff
Beispiel: Kupfer reagiert mit Sauerstoff



Beispiel: Kupferoxid reagiert mit Kohlenstoff



3. Redoxreaktion – neue Definition
Oxidation: Abgabe von Elektronen
Reduktion: Aufnahme von Elektronen
Beispiel: Kupferoxid reagiert mit Ethanol


Protokoll (Philipp): ProtokollPhilipp
Bio-Energetik
05/09/16 19:28
Bio-Energetik: Wie schafft es der Körper, die in den Lebensmitteln gespeicherte chemische Energie zu nutzen?
a) Fotosynthese: Sonnenenergie wird im Glucose-Molekül gespeichert;
Zellatmung: Die chemische Energie wird vom Glucose-Molekül auf das ATP-Molekül übertragen.

b) Das ATP-Molekül ist eine sehr energiereiche Verbindung, die überall im Organismus benötigt wird.


c) Die chemische Energie kommt aus dem im Glucose-Molekül "gespeicherten" Wasserstoff.
Dieser Wasserstoff wird bei den Abbauvorgängen des Glucose-Moleküls auf NAD+ übertragen.
Dabei entsteht NADH. Das NADH-Molekül ist der zentrale Wasserstoffspeicher im Organismus.

d) Im Gegensatz zur Knallgasreaktion (die letztlich nur Wärme produziert) wird der im NADH gespeicherte Wasserstoff über viele kleine
Reaktionsschritten in Wasser überführt. Bei jedem einzelnen Reaktionsschritt entsteht ATP.

e) Übersicht: Wo passiert was?
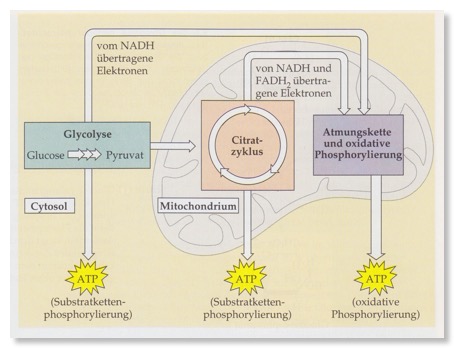
a) Fotosynthese: Sonnenenergie wird im Glucose-Molekül gespeichert;
Zellatmung: Die chemische Energie wird vom Glucose-Molekül auf das ATP-Molekül übertragen.

b) Das ATP-Molekül ist eine sehr energiereiche Verbindung, die überall im Organismus benötigt wird.


c) Die chemische Energie kommt aus dem im Glucose-Molekül "gespeicherten" Wasserstoff.
Dieser Wasserstoff wird bei den Abbauvorgängen des Glucose-Moleküls auf NAD+ übertragen.
Dabei entsteht NADH. Das NADH-Molekül ist der zentrale Wasserstoffspeicher im Organismus.

d) Im Gegensatz zur Knallgasreaktion (die letztlich nur Wärme produziert) wird der im NADH gespeicherte Wasserstoff über viele kleine
Reaktionsschritten in Wasser überführt. Bei jedem einzelnen Reaktionsschritt entsteht ATP.

e) Übersicht: Wo passiert was?

LZK Energetik
02/09/16 17:22
1. LZK Energetik
2. Basics (Luca): Chemische Formeln
Achtung! Warum ist die Formel Na-Cl falsch!!
Unterschied zwischen Verhältnisformeln für Ionenverbindungen (= Salze) Verhältnisformeln
und Summenformeln für Molekülverbindungen beachten!
2. Basics (Luca): Chemische Formeln
Achtung! Warum ist die Formel Na-Cl falsch!!
Unterschied zwischen Verhältnisformeln für Ionenverbindungen (= Salze) Verhältnisformeln
und Summenformeln für Molekülverbindungen beachten!

